Abonnieren Sie jetzt unseren Newsletter! (in englischer Sprache)
Newsletter
News
8. Dezember 2025
Merry Christmas and a Happy New Year from the SCTO
As 2025 comes to an end, we look back on a vibrant year for the SCTO. We entered a new funding period, set new strategic goals, and welcomed our new President. Our first Research-on-Research projects are underway, the SCTO Platforms released new templates, resources, and courses for clinical researchers, and we successfully held both the SCTO Forum and the SCTO Symposium. Simultaneously, our fully redesigned website is shaping up well and moving steadily toward launch.
In January 2026, we will proudly unveil our refreshed visual identity, featuring a redesigned logo, updated corporate design, and a modern website that brings together the content of scto.ch, sctoplatforms.ch, and cr-careers.ch. This new website will make it even easier to access tools, resources, and training opportunities across our SCTO Network, SCTO Platforms, and stakeholder community.
We wish you a wonderful Christmas season and a joyful start to 2026. May the new year bring you health, happiness, and success.
News
4. Novemer 2025
Coming soon: The SCTO’s new website
We are excited to announce that the SCTO will soon be launching its new website, featuring a fresh logo and an updated look that reflect our evolving identity.
The websites www.sctoplatforms.ch and www.cr-careers.ch will be merged with our main site www.scto.ch, which will have a new design, improved navigation, and easier access to key information for a more integrated user experience.
The SCTO’s new website will also include two helpful new features: a Tool Finder for quickly locating relevant clinical research tools and resources and a Course Finder for identifying suitable training opportunities for clinical researchers.
Stay tuned for the launch of the SCTO’s new website this December!
News
2. Juli 2025
Latest publication from DCR Bern: An approach to implementing patient and public involvement in investigator-initiated clinical trials
As interest in patient and public involvement (PPI) grows in academic clinical research, this Viewpoint publication by the Department of Clinical Research (DCR) Bern explores how to build a basic framework for effective collaboration in Switzerland. The authors highlight key insights for preparing researchers and PPI contributors to work together.
News
12. Juni 2025
SCTO Symposium 2025
Bridging the divide: Integrating clinical trials with medical care
Am 3. Juni 2025 versammelten sich über 160 Teilnehmende in Basel zum diesjährigen SCTO-Symposium, das gemeinsam vom Departement Klinische Forschung der Universität Basel und der Swiss Clinical Trial Organisation (SCTO) organisiert wurde.
Unter dem Thema Bridging the divide: Integrating clinical trials with medical care brachte die Veranstaltung Expertinnen und Experten sowie Interessierte aus der ganzen Schweiz zusammen, um eine der drängendsten Herausforderungen der klinischen Forschung zu beleuchten.
Entdecken Sie jetzt die Fotogalerie und laden Sie die Präsentationen hier herunter (in englischer Sprache).
News
20. Mai 2025
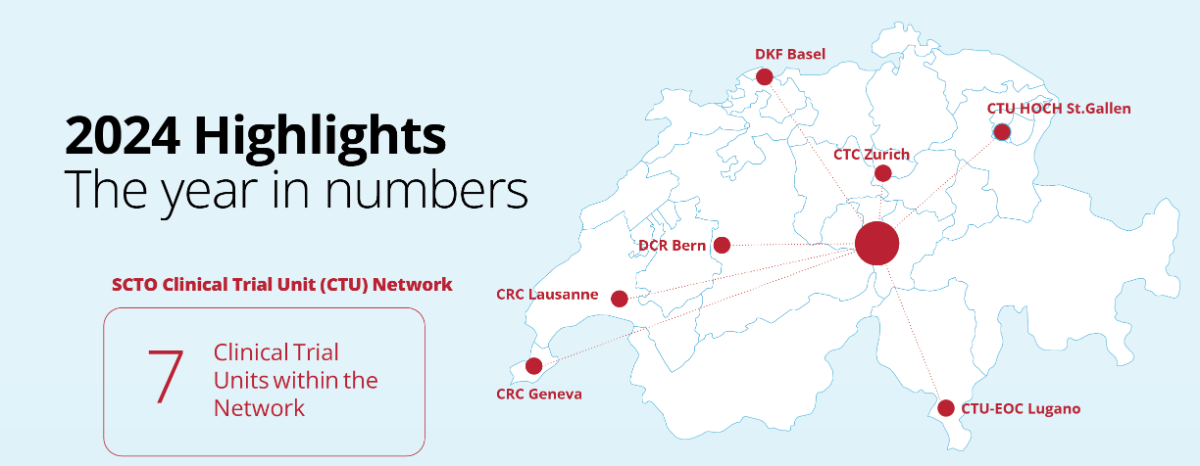
SCTO Annual Report 2024: A year of milestones and new beginnings
We invite you to explore the SCTO Annual Report 2024 and dive into the key achievements of our SCTO Clinical Trial Unit (CTU) Network and SCTO Platforms. The report highlights our efforts to strengthen harmonised clinical research through tools and resources for the clinical research community, our focus on patient and public involvement (PPI), and how we’ve engaged stakeholders through strategic communication and dialogue.
The year 2024 marks a major milestone: The successful conclusion of the 2021–2024 funding period. Over these years, the SCTO has made significant strides in advancing and harmonising high-quality clinical research in Switzerland—driven by collaboration, innovation, and education.
Looking ahead, we’re proud to share that the SCTO has secured renewed funding from the Swiss National Science Foundation (SNSF) and the State Secretariat for Education, Research and Innovation (SERI) for the 2025–2028 period. This continued support paves the way for new strategic directions in a dynamic clinical research environment.

News
20. Mai 2025
A new era for the SCTO: Welcoming our new President, Prof. Dr. med. Alessandro Ceschi, M.Sc.
On Tuesday, 13 May 2025, the SCTO General Meeting of Members elected the SCTO organs for the 2025–2028 period, including a new President and a Steering Board member. During the General Assembly, a review of the SCTO’s 2024 activities, a look ahead to the new funding period, and updates from key stakeholders have been presented.
After seven years of dedicated leadership by Prof. Dr. med. Christiane Pauli-Magnus, Co-Director of the Department of Clinical Research at University Hospital Basel, the General Meeting of Members has elected Prof. Dr. med. Alessandro Ceschi, M.Sc., Chief of Medical Education and Research at General Directorate of the Ente Ospedaliero Cantonale (EOC) in Lugano, as the new President of the SCTO.
About Prof. Ceschi
Prof. Dr. med. Alessandro Ceschi, M.Sc. is a board certified clinical pharmacologist and toxicologist, and general internal medicine specialist physician. He currently serves as Chief of Medical Education and Research of the General Directorate of the EOC, which includes the Clinical Trial Unit (CTU-EOC). Additionally, he is Chief Physician of the Division of Clinical Pharmacology and Toxicology and Medical and Scientific Director of the Institute of Pharmacological Sciences of Southern Switzerland, both based at the EOC. He is professor at Università della Svizzera italiana (USI) and senior lecturer at University of Zurich and University of Basel.
Member of the SCTO Steering Board since April 2023, Prof. Ceschi will assume the role of President as of 1 September 2025. His wide-ranging responsibilities and experience reflect his strong commitment to advancing clinical research, medical education, and patient care across Switzerland and beyond.
The SCTO sincerely thanks Prof. Dr. med. Christiane Pauli-Magnus for her remarkable leadership and tireless dedication over the past seven years. Her vision has significantly shaped the SCTO and strengthened Switzerland’s position in the field of clinical research. The SCTO is pleased that Prof. Pauli-Magnus will continue to contribute her expertise as a valued member of the SCTO Steering Board.
We warmly congratulate Prof. Dr. med. Alessandro Ceschi, M.Sc., on his appointment and look forward to continued growth under his leadership.
New member of the Steering Board
In addition, the SCTO is pleased to announce that Prof. Dr. Jörg Goldhahn, Privatdozent at the Department of Health Sciences and Technology at ETH Zürich and representative of the Collège des Doyens (Deans of the Medical Faculties of the Swiss Universities), has been elected to the SCTO Steering Board, succeeding Prof. Dr. Primo Schär. All the other current Steering Board members have been re-elected.
The SCTO extends its sincere gratitude to all Steering Board members for their valuable contributions and continued support.
News
13. März 2025
Registrieren Sie sich für das SCTO-Symposium 2025 | Bridging the divide: Integrating clinical trials with medical care
Das diesjährige SCTO-Symposium konzentriert sich darauf, die Lücke zwischen dem Wissen aus randomisierten kontrollierten Studien und seiner Anwendung in der klinischen Praxis zu schliessen.
Nehmen Sie am Dienstag, den 3. Juni 2025, von 09:30 bis 16:30 in Basel teil und erfahren Sie, wie klinische Studien erfolgreich in die tägliche medizinische Praxis integriert werden können. Wir werden wichtige Themen behandeln, wie unter anderem die Entwicklung der regulatorischen Rahmenbedingungen, die Flexibilität von Studiendesigns und die Stärkung der Dateninfrastrukturen.
Gemeinsam organisiert vom Department Klinische Forschung, Universität Basel und der Swiss Clinical Trial Organisation, verspricht diese Veranstaltung eine aufschlussreiche Diskussion darüber, wie wir die Ergebnisse für Patientinnen und Patienten verbessern können, indem Wissenschaft und Praxis näher zusammengebracht werden.
Erfahren Sie mehr über das Programm hier und melden Sie sich noch heute an. Die Veranstaltung wird in englischer Sprache abgehalten.
Wir freuen uns darauf, Sie zu dieser wichtigen Veranstaltung in Basel begrüssen zu dürfen!
News
28. Februar 2025
PPI-Online-Kurs für SNF IICT-Gesuchstellende 2025
Der Schweizerische Nationalfonds (SNF) schreibt zum elften Mal das Förderprogramm für Investigator Initiated Clinical Trials (IICT) aus und unterstützt damit klinische Studien, die sowohl aus medizinischer als auch aus gesellschaftlicher Sicht nicht ausreichend erforscht sind.
Unter anderem muss aus der Teilnahmeabsichtserklärung (Letter of Intent, LOI) und dem Gesuch hervorgehen, wie die Gesuchstellenden Patientinnen und Patienten sowie die Öffentlichkeit aktiv in ihre Forschungsprojekte einbinden (patient and public involvement, PPI).
Am 1. April 2025 bietet die SCTO einen Onlinekurs zu diesen PPI-Anforderungen für Forschende an, die sich für das IICT-Förderprogramm 2025 bewerben möchten. In diesem Kurs werden wir den Teilnehmenden Beispiele und praktische Tipps geben, wie sie die PPI-Anforderungen des IICT erfolgreich umsetzen können. Dieser Online-Kurs ist kostenlos und wird in englischer Sprache abgehalten.
Registrieren Sie sich jetzt für den Online-Kurs.
Einreichung des LOI muss bis zum 27. Mai 2025 erfolgen. Die Frist zur Einreichung der Gesuche ist der 4. November 2025.
- Programme und Anmeldung für den SCTO Online-Kurs, organisiert in Zusammenarbeit mit dem SNSF (auf Englisch): «SNSF IICT 2025 Application: How to Successfully Address the PPI Requirement»
- Mehr zur aktuellen Ausschreibung «Investigator Initiated Clinical Trials (IICT)»
News
20. Februar 2025
ECRIN: International Clinical Trials Day (ICTD) 2025
Das European Clinical Research Infrastructure Network (ECRIN) lädt Sie ein zum International Clinical Trials Day (ICTD) 2025 am Dienstag, den 20. Mai 2025 in Madrid, Spanien.
Mit dem Thema «Rethinking Clinical Trials: Inclusivity in Practice» wird diese Veranstaltung die zentrale Frage beantworten: Wie gehen wir vom Gespräch zur Handlung, um sicherzustellen, dass die richtigen Bevölkerungsgruppen bei der Gestaltung einer klinischen Studie berücksichtigt werden? Und mehr.
Erfahren Sie hier mehr über den ICTD 2025.
Nehmen Sie an dieser spannenden Veranstaltung teil, vor Ort oder online.
Die Veranstaltung findet in englischer Sprache statt.
News
4. Februar 2025
Regulatory Shake-Up: Key Changes Impacting Clinical Research
Insights into the new ICH GCP E6(R3) and beyond
Das SCTO Forum 2025, das am 29. Januar in Bern stattfand, behandelte wichtige Aktualisierungen der ICH GCP E6(R3) Guidelines mit dem Ziel, die Flexibilität, Effizienz und Datenintegrität in klinischen Studien zu verbessern. 77 Personen nahmen an dieser spannenden Veranstaltung teil. Die Vorträge befassten sich mit der Begründung der Revisionen, Real-World Evidence und Quality by Design.
Wichtige Erkenntnisse:
- Eine kontinuierliche Reflexion ist für die Entscheidungsfindung unerlässlich.
- Forschende müssen sich sowohl mit den GCP E6 als auch mit den E8 Guidelines auseinandersetzen.
- Die Revisionen bieten genügend Vorbereitungszeit und zielen darauf ab, die Praxis klinischer Studien zu verbessern.
Erfahren Sie mehr über das SCTO Forum und laden Sie die Präsentationen hier herunter.
News
24. Januar 2025
Positive Beurteilung der SCTO durch den Schweizerischen Wissenschaftsrat
Der Schweizerische Wissenschaftsrat (SWR) hat seinen Bericht «Forschungseinrichtungen von nationaler Bedeutung (Art. 15 FIFG): Begutachtung der Gesuche für die BFI-Periode 2025-2028“ veröffentlicht. Diese vom Staatssekretariat für Bildung, Forschung und Innovation (SBFI) in Auftrag gegebene Evaluation bildet die Grundlage für die Mittelvergabe des SBFI.
Die SCTO hat eine positive Evaluation erhalten, die ihre Schlüsselrolle als Forschungsinfrastruktur für die Weiterentwicklung der klinischen Forschungslandschaft in der Schweiz bestätigt. Der Bericht unterstreicht die zentrale Rolle der SCTO bei der Optimierung und Harmonisierung von Prozessen, Best Practices und Methoden in der klinischen Forschung durch ihre Plattformen und die Unterstützung von Clinical Trial Units (CTUs).
Lesen Sie diesen interessanten Bericht hier.
News
24. Januar 2025
Positive Beurteilung der SCTO durch den Schweizerischen Wissenschaftsrat
Der Schweizerische Wissenschaftsrat (SWR) hat seinen Bericht «Forschungseinrichtungen von nationaler Bedeutung (Art. 15 FIFG): Begutachtung der Gesuche für die BFI-Periode 2025-2028“ veröffentlicht. Diese vom Staatssekretariat für Bildung, Forschung und Innovation (SBFI) in Auftrag gegebene Evaluation bildet die Grundlage für die Mittelvergabe des SBFI.
Die SCTO hat eine positive Evaluation erhalten, die ihre Schlüsselrolle als Forschungsinfrastruktur für die Weiterentwicklung der klinischen Forschungslandschaft in der Schweiz bestätigt. Der Bericht unterstreicht die zentrale Rolle der SCTO bei der Optimierung und Harmonisierung von Prozessen, Best Practices und Methoden in der klinischen Forschung durch ihre Plattformen und die Unterstützung von Clinical Trial Units (CTUs).
Lesen Sie diesen interessanten Bericht hier.
News
20. Januar 2025
SCTO Forum 2025
Regulatory Shake-Up: Key Changes Impacting Clinical Research
Insights into the new ICH GCP E6(R3) and beyond
Das SCTO Forum 2025 findet am Mittwoch, 29. Januar 2025 in Bern statt und befasst sich mit den Aktualisierungen der ICH-GCP E6(R3) Guideline mit Fokus auf Flexibilität, Effizienz und Datenintegrität in klinischen Studien. Zu den Themen gehören die Gründe für die Revisionen, das Feedback der Stakeholder und die Auswirkungen auf die Schweizer Forschung sowie Qualität durch Design und innovative Studiendesigns.
Diese SCTO-Veranstaltung ist Mitgliedern des SCTO-Netzwerks der Clinical Trial Units (CTUs) und Partnerorganisationen vorbehalten.
News
3. Oktober 2024
Online seminar: HRA ordinances – what has changed?
Die SCTO freut sich, ein bevorstehendes Online-Seminar anzukündigen, das von der Regulatory Affairs-Plattform und der Education-Plattform organisiert wird und sich mit den neuesten Änderungen der Verordnungen zum Humanforschungsgesetz (HFG) befasst. Die revidierten Verordnungen treten am 1. November 2024 in Kraft.
Dieses einstündige Seminar ist ein wichtiges Update für alle Personen, die in der klinischen Forschung tätig sind und bietet wichtige Einblicke in die neuen gesetzlichen Änderungen.
Das Seminar findet am Montag, 28. Oktober, von 12.00-13.00 Uhr statt.
Der Zoom-Link für dieses Seminar steht auf unserer SCTO-Plattformen-Website zum Download bereit.
Lassen Sie sich diese wertvolle Lerngelegenheit nicht entgehen!
News
12. August 2024
Zweite Runde des «HRO-Lunch» der SCTO Education-Plattform
Zwischen September und Dezember 2024 werden vier zusätzliche Sessions angeboten, die wichtige Einblicke und praktisches Wissen für Beobachtungs- und Weiterverwendungsprojekte vermitteln.
Die Sitzungen werden sich mit folgenden Themen befassen:
- BASEC – A practical walk-through for HRO projects
- Mastering Consent: Key insights into general and informed consent for HRO projects
- Data sharing and open research data – details for HRO projects
- Sample management and biobanking – essentials for HRO projects
Die Sitzungen werden online als Zoom-Sitzung abgehalten und bieten den Forschenden ausreichend Zeit, um Fragen zu stellen.
Die Teilnahme ist kostenlos. Die Sitzungen finden in englischer Sprache statt.
Melden Sie sich hier für diese interessanten Sitzungen an: Seminar series: Facts and pitfalls of observational studies – How to plan and conduct HRO projects
News
20. Juni 2024
Highlights des SCTO-Symposiums 2024: Spannende Präsentationen zur datengetriebenen klinischen Forschung!
Das zwölfte SCTO-Symposium war dem Thema "Working towards efficient clinical data-driven research in Switzerland" gewidmet und fand am 11. Juni in Lausanne statt.
Wir hatten die Gelegenheit, aufschlussreiche Präsentationen über die Gegenwart und Zukunft der datengetriebenen klinischen Forschung von inspirierenden Referentinnen und Referenten aus der ganzen Schweiz zu hören. Nach jeder Session fand eine fruchtbare Diskussion zwischen den Referentinnen und Referenten und dem Publikum zu diesen aktuellen Themen statt.
Das Symposium wurde gemeinsam von der SCTO und dem Clinical Research Center (CRC) in Lausanne organisiert. 170 Personen besuchten die Veranstaltung.
Eine kurze Zusammenfassung der verschiedenen Präsentationen und die Slides finden Sie unter SCTO-Symposium 2024.
News
19. Juni 2024
Der «NextGen Research Day 2024» von SwissPedNet ist nun ein offizielles Vorprogramm des jährlichen pädiatrie schweiz Kongresses!
Am 5. Juni 2024 traf sich eine motivierte Gruppe junger Schweizer Pädiatrie-Forschende in Sursee zum «NextGen Research Day», einem offiziellen Vorprogramm zum Jahreskongress von pädiatrie schweiz. Der «NextGen Research Day» wird vom Schweizer Netzwerk der pädiatrischen Forschungszentren (SwissPedNet) mit der Unterstützung der Swiss Clinical Trial Organisation (SCTO) organisiert. 29 Teilnehmende besuchten den Event. Bei den Teilnehmenden handelte es sich um niedergelassene und leitende Pädiater und Pädiaterinnen, Masterstudierende, Doktoranden, Postdocs sowie Forschende aus anderen verwandten Bereichen wie Kinderpsychologie oder Kinderkrankenpflege.
Der «NextGen Research Day» umfasste mehrere Workshops, an denen die jungen pädiatrischen Forschenden in kleinen Gruppen teilnehmen und von Expertinnen und Experten auf diesem Gebiet lernen konnten: Eine Speed-Dating-Sitzung mit Expertinnen und Experten sowie ein wissenschaftlicher Escape Room, in dem die Teilnehmenden eine klinische Forschungsaufgabe lösen mussten. Beim Mittagessen und in den Kaffeepausen gab es viele lebhafte Diskussionen zwischen den Teilnehmenden und mit den Expertinnen und Experten.
In diesem Jahr wurde der «NextGen Research Day» zum ersten Mal als offizielles Vorprogramm zum jährlichen pädiatrie schweiz Kongress vom 6. und 7. Juni 2024 organisiert und kommuniziert. Wir hoffen, dass die Kommunikation auf dem Kongress sowie die hervorragende Qualität der Veranstaltung 2024 uns helfen werden, ein noch grösseres Publikum für den «NextGen Research Day 2025» zu erreichen.
Wir danken Pfizer AG, Novartis Pharma Schweiz AG, AbbVie Inc. und Eli Lilly (Suisse) S.A. für ihre finanzielle Unterstützung.
News
18. Juni 2024
Horizons – The Swiss Research Magazine
Die Stimmen der Betroffenen: Die SCTO über ihr Engagement für Patient and Public Involvement (PPI) in der klinischen Forschung.
Ohne klinische Studien käme die medizinische Wissenschaft nicht voran. Doch allzu oft werden dabei die Bedürfnisse der Patientinnen und Patienten ignoriert. Das soll sich jetzt ändern.
Die Einbeziehung von Patientinnen und Patienten sowie der Öffentlichkeit in die klinische Forschung ist von grossem Wert, da Menschen, die mit einer bestimmten Krankheit oder einem bestimmten Leiden leben, über ein Verständnis und Wissen verfügen, das zur Entwicklung und Verbesserung der Gesundheitsversorgung beitragen kann.
Die Schweiz befindet sich jedoch noch in einem frühen Stadium der Entwicklung von Patient and Public Involvement (PPI). «Wenn unsere Studien patientenfreundlicher werden, könnte es in Zukunft auch einfacher werden, genügend Studienteilnehmende zu rekrutieren und sie auch an Bord zu halten» (Sabine Rütti Roch, SCTO).
Aus diesem Grund hat die SCTO verschiedene Ressourcen für Patientenvertreterinnen und klinische Forschende entwickelt und möchte eine Plattform schaffen, die Forschende und Patientinnen sowie Patienten zusammenbringt.
Lesen Sie diesen interessanten Artikel aus dem Horizons Magazine, an dem die SCTO mitgewirkt hat (in englischer Sprache).
News
23. Mai 2024
SCTO Jahresbericht 2023
Im Jahr 2023 haben die SCTO und ihr Netzwerk ihre Mission fortgesetzt, qualitativ hochwertige klinische Forschung zu ermöglichen. In unserem Jahresbericht 2023 können Sie alle wichtigen Aktivitäten nachlesen, die in unseren verschiedenen Kernbereichen stattgefunden haben.
Hier sind einige unserer Highlights aus dem Jahr 2023:
- Unser CTU-Netzwerk war an mehr als 2000 klinischen Forschungsprojekten beteiligt und hat mehr als 8000 Mitarbeitende in der klinischen Forschung geschult.
- Die SCTO-Plattformen haben fünf neue Tools entwickelt und der klinischen Forschungsgemeinschaft zur Verfügung gestellt sowie sechs Publikationen veröffentlicht.
- Patient and Public Involvement (PPI) wurde in verschiedene Certificate of Advanced Studies (CAS)-Programme aufgenommen, und die European Patients' Academy on Therapeutic Innovation (EUPATI) Schweiz führte ihre erste Schulung für Patientenexperten durch.
- Die Schweiz wurde Vollmitglied des European Clinical Research Infrastructure Network (ECRIN), wodurch die Schweizer Forschungsgemeinschaft vollen Zugang zu den Dienstleistungen von ECRIN erhält.
- Über 400 Teilnehmende besuchten unsere sechs Veranstaltungen.
Im kommenden Jahr wird die SCTO ihre Mission gegenüber der Forschungsgemeinschaft fortsetzen, indem sie die Zusammenarbeit zwischen den nationalen Forschungsinfrastrukturen fördert und intensiviert, das Netzwerk der Clinical Trial Units (CTUs) stärkt und die Harmonisierung der klinischen Forschung durch entsprechende Instrumente, Richtlinien und Dienstleistungen vorantreibt.
Hier geht's zum Jahrsbericht (in Englisch).
News
11. April 2024
Young Talents in Clinical Research
Mit dem Förderprogramm «Young Talents in Clinical Research» (YTCR) ermöglichen die Gottfried und Julia Bangerter-Rhyner-Stiftung und die SAMW jungen interessierten Ärztinnen und Ärzten eine erste Forschungserfahrung. 2024 stehen erneut 1 Million CHF zur Verfügung, um Nachwuchskräften «protected research time» bzw. die Durchführung eines eigenen Forschungsprojekts zu finanzieren. Eingabefrist für Gesuche ist am 30. Juni 2024.
Zur Ausschreibung: https://www.samw.ch/de/Foerderung/Young-Talents-in-Clinical-Research.html
Weitere Finanzierungsmöglichkeiten für junge klinische Forschende finden Sie auf der Webseite Clinical Reserch Careers: https://cr-careers.ch/
News
27. März 2024
Umfrage von ECRIN zu nationalen Registern für Beobachtungsstudien und zur gemeinsamen Nutzung von Daten einzelner Teilnehmenden
Register für klinische Studien sind etablierte Instrumente, die in der klinischen Forschung weit verbreitet sind. Die Zahl der registrierten klinischen Prüfungen hat zugenommen, doch die Zahl der Beobachtungsstudien ist nach wie vor sehr gering. In acht europäischen Ländern, die dem European Clinical Research Infrastructure Network (ECRIN) angehören, wurde eine Umfrage durchgeführt, um den Stand der nationalen Entwicklungen in Bezug auf Register für klinische Beobachtungsstudien zu bewerten. Die SCTO leistete einen aktiven Beitrag zu dieser Umfrage, die zusätzlich auf den Bedarf und die Anforderungen für die gemeinsame Nutzung von Daten individueller Teilnehmenden (IPD) aus klinischen Prüfungen/klinischen Studien ausgerichtet war.
Sechs der acht Länder, die an der Umfrage teilnahmen, berichteten über nationale Registeraktivitäten für Beobachtungs- oder Gesundheitsstudien. Die Autorinnen und Autoren der Umfrage schlugen vor, dass ein erster Schritt zur Verbesserung darin bestehen könnte, die nationalen Register in das ECRIN-Metadatenregister für klinische Forschung (crMDR) zu integrieren, das alle Primärregister der International Clinical Trials Registry Platform (ICTRP) der Weltgesundheitsorganisation sowie ClinicalTrials.gov, Pubmed und einige Repositories für den Austausch von IPD umfasst.
Lesen Sie die vollständige Studie Survey by ECRIN on national registries for observational studies and sharing of individual participant data von Christian Ohmann et al., Zenodo, veröffentlicht am 25. März 2024.
News
19. März 2024
Onlinekurs für IICT-Gesuchstellende 2024 «How to Successfully Address the PPI Requirement»: Video und Präsentationen online
Bereits zum zehnten Mal schreibt der Schweizerische Nationalfonds (SNF) das Förderprogramm für Investigator Initiated Clinical Trials (IICT) aus und unterstützt damit klinische Studien, die ein aus medizinischer als auch gesellschaftlicher Sicht nicht ausreichend erforschtes Thema adressieren. Aus der Teilnahmeabsichtserklärung (Letter of Intent, LOI) und dem Gesuch muss u. a. hervorgehen, wie die Gesuchstellenden Patientinnen und Patienten und die Öffentlichkeit aktiv in ihre Forschungsprojekte einbinden oder welche Pläne sie diesbezüglich haben (Stichwort: Patient and Public Involvement, kurz PPI).
Für interessierte Forschende, die sich für das IICT-Förderprogramm 2024 bewerben möchten, hat die SCTO zusammen mit Expertinnen vom SNF, des Departements für Klinische Forschung Basel (DKF Basel) und des Centre hospitalier universitaire vaudois (CHUV) am 18. März einen PPI Onlinekurs organisiert. Wir sind dabei u. a. auf die Frage eingegangen, warum PPI für die Planung und Durchführung klinischer Studien besonders nützlich ist und haben praktische Tipps und Beispiele für eine wirkungs- und sinnvolle Herangehensweise gegeben, einschliesslich hilfreicher Tipps, wie die PPI-Anforderung erfüllt werden können. Der Onlinekurs wurde aufgenommen und ist in Englischer Sprache verfügbar.
News
15. März 2024
Neue Studie unter Mitwirkung der SCTO veröffentlicht: Wo liegen die Engpässe beim Austausch von Gesundheitsdaten in der Schweiz? Eine Interviewstudie.
Die gemeinsame Nutzung von Gesundheitsdaten für die Forschung erfordert die Koordination zahlreicher Faktoren, darunter Regulierung, Zugang, Interoperabilität, Standardisierung und Zusammenarbeit zwischen Forschenden und Patientinnen und Patienten. Dieser Prozess stösst in der Schweiz wie auch anderswo auf verschiedene Hindernisse und Engpässe, nicht nur auf internationaler Ebene oder mit Dritten, sondern auch innerhalb der Schweizer Universitätsspitäler.
Der kürzlich in der Swiss Medical Weekly erschienene Artikel beleuchtet die rechtlichen, ethischen und technischen Herausforderungen des Datenaustauschs in der Schweiz. Die Interviewstudie wurde von unseren SCTO Regulatory-Affairs-Plattform Mitgliedern Claudia Becherer und Elke Hiendlmeyer in Zusammenarbeit mit verschiedenen Organisationen wie dem Health and Policy Lab der ETH Zürich, dem Swiss Personalized Health Network (SPHN), der Swiss Biobanking Platform und dem Bern Center for Precision Medicine durchgeführt.
Die Mehrheit, der in den halbstrukturierten Interviews befragten Personen ist der Ansicht, dass die komplexesten und verwirrendsten Aspekte des Datenaustauschs nicht in der Datenübermittlung selbst liegen, sondern in den damit verbundenen Prozessen und Systemen. Die Unsicherheiten beziehen sich auf Datenschutzgesetze, Fragen des Dateneigentums sowie Anonymisierungs- und Pseudonymisierungsverfahren. Die Studie kommt zum Schluss, dass zur Erleichterung des Datenzugangs und -austauschs in der Schweiz vor allem weitere rechtliche Abklärungen, Ausbildungen und Investitionen in nachhaltige Infrastrukturen notwendig sind.
What are the bottlenecks to health data sharing in Switzerland? An interview study von Kelly E. Ormond et al., erschienen am 22. Januar 2024 in Swiss Medical Weekly (in Englisch)
Event
11. März 2024
SCTO-Symposium: Working towards efficient clinical data-driven research in Switzerland
Das diesjährige SCTO-Symposium, das am Dienstag, 11. Juni in Lausanne stattfindet, widmet sich dem Thema «Working towards efficient clinical data-driven research in Switzerland».
Das Volumen und die Komplexität der in der klinischen Forschung generierten Daten haben aufgrund verschiedener Faktoren stark zugenommen. Die Art und Weise, wie klinische Studiendaten generiert, verwaltet und gemeinsam genutzt werden (Datenflüsse in einer klinischen Studie), wird immer wichtiger, um sowohl in nationalen als auch in multinationalen Studienumgebungen effiziente Ergebnisse zu erzielen.
Nehmen Sie am SCTO-Symposium teil, um sich mit den Herausforderungen vertraut zu machen, denen klinische Forschende, die Clinical Trial Units (CTUs) der SCTO, Datenzentren und Biobanken in diesem aktuellen Umfeld gegenüberstehen. Wir werden eine Reihe verwandter Themen ansprechen, darunter regulatorische Überlegungen, IT- und Infrastrukturanforderungen, Datenverwaltung und gemeinsame Datennutzung.
Das Symposium wird von der SCTO und dem Clinical Research Centre (CRC) in Lausanne organisiert. Die Konferenzsprache ist Englisch.
Besuchen Sie unsere Veranstaltungswebsite für weitere Informationen, wir freuen uns auf Sie!
Programm und Anmeldung: SCTO-Symposium
Event
29. Februar 2024
Nachwuchsforschende in der Pädiatrie aufgepasst: Innovativer Anlass steht vor der Tür
Der «NextGen Research Day» ist ein innovatives Trainingsangebot für junge Forschende oder Doktoranden im Bereich der pädiatrischen klinischen Forschung. Der Event wird von SwissPedNet, dem Schweizer Netzwerk der pädiatrischen Forschungszentren organisiert. Teilnehmende erfahren, welche Kenntnisse und Fähigkeiten zur Durchführung von klinischen Studien oder Forschungsprojekten erforderlich sind und erhalten das notwendige Werkzeug für eine erfolgreiche Durchführung ihrer Projekte.
Wann? 5. Juni 2024
Wo? Kantonsspital Luzern
Anmeldung und weitere Informationen NextGen Research Day 2024 (in English)
Event
28. Februar 2024
SCTO-Onlinekurs für IICT-Gesuchstellende 2024
Der Schweizerische Nationalfonds (SNF) schreibt zum zehnten Mal das Förderprogramm für Investigator Initiated Clinical Trials (IICT) aus und unterstützt damit klinische Studien, die aus medizinischer als auch gesellschaftlicher Sicht nicht ausreichend erforscht sind. Unter anderem muss aus der Teilnahmeabsichtserklärung (Letter of Intent, LOI) und dem Gesuch hervorgehen, wie die Gesuchstellenden Patientinnen und Patienten und die Öffentlichkeit aktiv in ihre Forschungsprojekte einbinden (Patient and Public Involvement, kurz PPI).
Am 18. März bietet die SCTO einen Onlinekurs zu diesen PPI-Anforderungen für Forschende an, die sich für das IICT-Förderprogramm 2024 bewerben möchten. In diesem Kurs werden wir den Teilnehmenden Beispiele und praktische Tipps geben, wie sie die PPI-Anforderungen des IICT erfolgreich umsetzen können. Dieser Onlinekurs ist kostenlos und wird in englischer Sprache abgehalten. Bitte melden Sie sich online an.
Das Portal mySNF steht ab Mitte April 2024 zur Verfügung. Die Einreichung des LOI muss bis zum 27. Mai 2024 erfolgen. Die Frist zur Einreichung der Gesuche ist der 1. November 2024.
- Anmeldung und Programm Onlinekurs (in Englisch):
«IICT 2024 Application: How to Successfully Address the PPI Requirement» - Mehr zur aktuellen Ausschreibung «Investigator Initiated Clinical Trials (IICT)»
Event
22. Februar 2024
Neue SCTO-Plattform Seminarreihe: «Facts and pitfalls of observational studies – How to plan and conduct HRO projects»
Die neue Mittagsseminarreihe, die von der Education-Plattform der SCTO entwickelt wurde, gibt einen kompakten Überblick über die qualitativen, regulatorischen und rechtlichen Anforderungen an die Durchführung und Planung von Beobachtungsstudien (Projekte, die der Humanforschungsverordnung (HRO) unterliegen).
Von März bis Mai sind vier Online-Seminare geplant, für die Sie sich jetzt anmelden können. Bitte beachten Sie, dass diese Seminare kostenlos sind und in englischer Sprache abgehalten werden.
Weitere Informationen und Anmeldung: «Facts and pitfalls of observational studies – How to plan and conduct HRO projects»
Event
22. Februar 2024
Zweiter EUPATI CH Patientenschulungskurs
Bei der Patienten- und Öffentlichkeitsbeteiligung (PPI) bringen Patienten und Mitglieder der Öffentlichkeit ihre persönlichen Erfahrungen mit einer Erkrankung in ein Forschungsprojekt ein, indem sie die Ziele und die Gestaltung des Projekts aktiv mitgestalten und das Projekt evaluieren.
Zur Vorbereitung von Personen, die sich als PPI-Mitwirkende an der Konzeption und Auswertung von Studien beteiligen möchten, bieten die schweizerische Landesplattform der Europäische Patientenakademie (EUPATI CH) gemeinsam mit dem Departement Klinische Forschung der Universität Basel zum zweiten Mal den Ausbildungskurs zur/zum «EUPATI Schweiz Patientenexpertin/-experten» an (in deutscher Sprache). Der erste Kurs wurde im Dezember 2023 erfolgreich abgeschlossen, der zweite Kurs wird im April 2024 stattfinden (Anmeldeschluss: 15. März).
Weitere Informationen finden Sie bei EUPATI CH.
Event
22. Februar 2024
D|A|CH-Symposium 2024: 16. und 17. September in Berlin
Das diesjährige trinationale Symposium über klinische Prüfungen in Deutschland, Österreich und der Schweiz (D|A|CH) findet am 16. und 17. September in Berlin statt.
Das vierte D|A|CH-Symposium bietet Programmpunkte für Anfänger und Fortgeschrittene mit über 50 Referent/innen sowie Expert/innen aus drei Ländern. Zu den Themen gehören Clinical Trial Regulation, Patient Involvement, Patientenaufklärung, Decentralised Trials, Fachkräftemangel, Datenschutz, Medizinprodukte und viele mehr. Die SCTO ist Teil des Programmkomitees, und Mitglieder des SCTO-Netzwerks werden als Referent/innen am diesjährigen D|A|CH-Symposium teilnehmen.
Diese Veranstaltung findet in deutscher Sprache statt. Frühbucheranmeldungen mit Preisnachlass sind bis zum 28. Februar möglich.
Weitere Informationen, das Programm und die Anmeldung finden Sie auf der Website des D|A|CH-Symposiums.

Event
2. Februar 2024
SCTO-Forum 2024: Präsentationen online
Am 31. Januar 2024 fand das jährliche SCTO-Forum in Bern statt; dieses Jahr haben wir uns mit der komplexen regulatorischen Umgebung der klinischen Forschung auseinandergesetzt und uns mit der Überarbeitung der Verordnungen im Zusammenhang mit dem Humanforschungsgesetz (HFG) befasst. Gemeinsam mit den 78 Teilnehmerinnen und Teilnehmer haben wir die durch diese Überarbeitung ausgelösten aktuellen Themen erkundet, was zu aufschlussreichen Diskussionen führte.
Die Präsentationen im PDF-Format finden Sie auf unserer Website: SCTO-Forum 2024

Event
26. Januar 2024
SCTO-Symposium 2024: Save the Date
Am 11. Juni 2024 findet in Lausanne das SCTO-Symposium 2024 statt. Gemeinsam mit dem Clinical Research Centre (CRC) Lausanne organisiert die SCTO ihr Symposium zum Thema «Working towards efficient clinical data driven research in Switzerland».
Der Anlass findet in englischer Sprache statt. Die Anmeldung startet in Kürze – reservieren Sie sich schon heute den 11. Juni!
News
26. Januar 2024
Artikel über die Patienten- und Öffentlichkeitsbeteiligung in der Schweizerischen Ärztezeitung
Der unten verlinkte Artikel, der in der letzten Ausgabe der Schweizerischen Ärztezeitung erschien, beleuchtet die Mitwirkung von Patientinnen und Patienten im Schweizer Gesundheitswesen.
Die SCTO leistet einen bedeutenden Beitrag zur Patienten- und Öffentlichkeitsbeteiligung (Patient and Public Involvement, kurz PPI) in der akademischen klinischen Forschung. Wir unterstützen zahlreiche PPI-Projekte in der Schweiz mit der Bereitstellung von Trainings und der Entwicklung von PPI-Ressourcen.
Lesen Sie den Artikel online: Teilhabe braucht einen Dialog auf Augenhöhe von Adrian Ritter, erschienen am 24. Januar 2024, in der Schweizerischen Ärztezeitung
Erfahren Sie mehr über die SCTO PPI-Ressourcen und das PPI-Mapping.